医薬品医療機器等法(薬機法)に基づくサービス内容
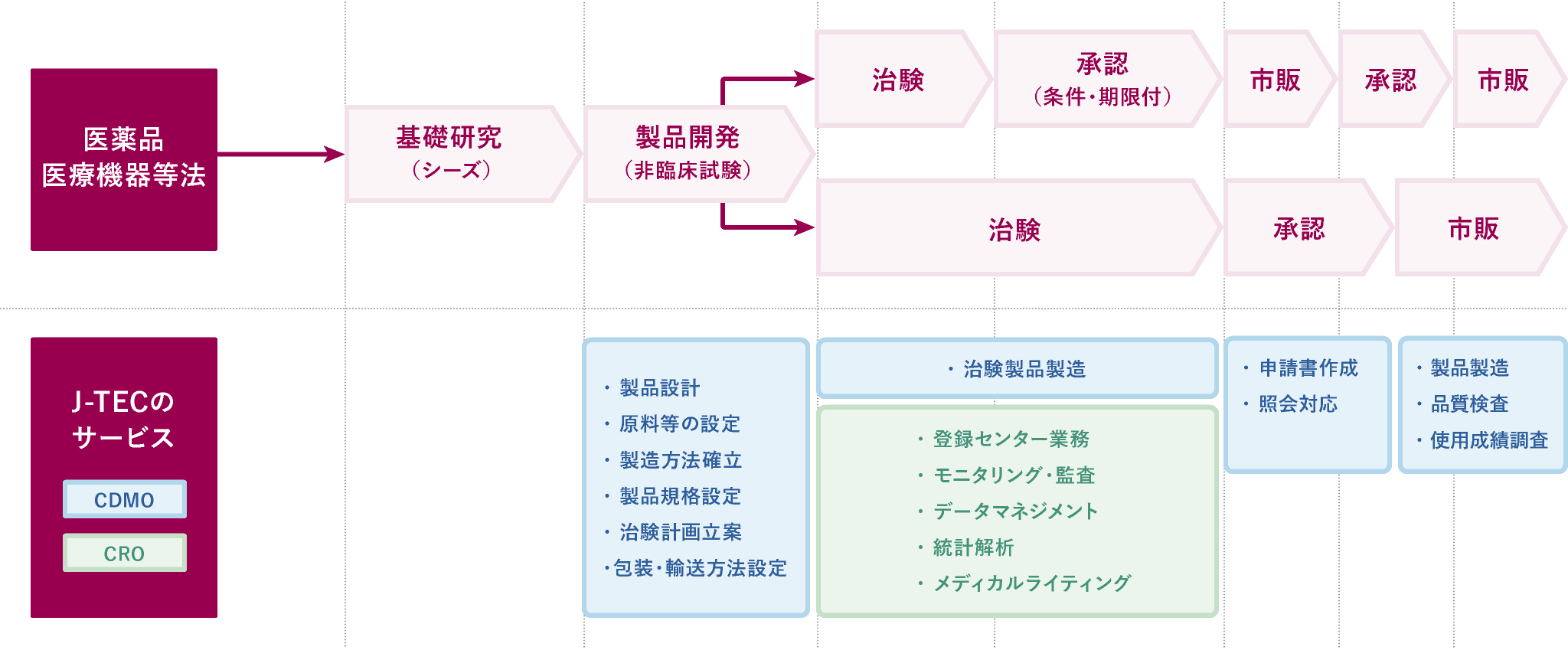
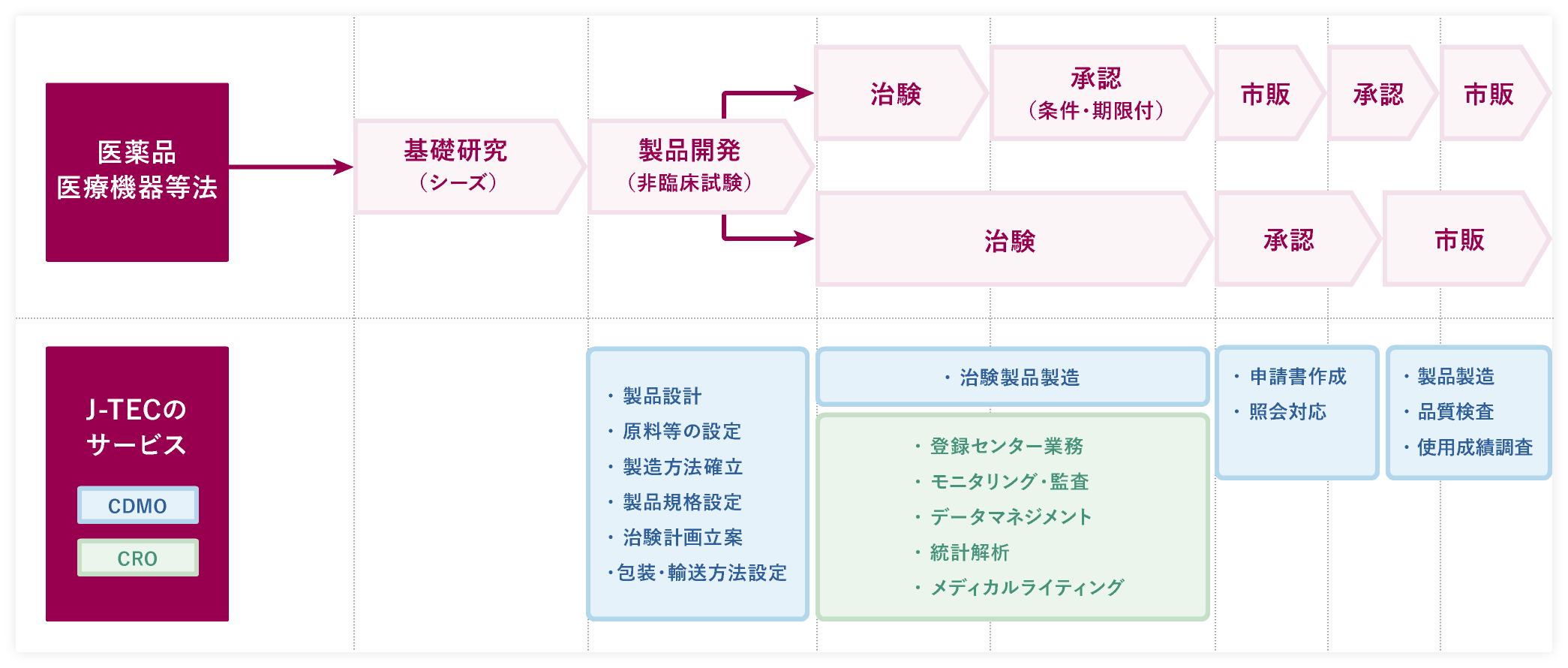
- 製品開発(非臨床試験)
-
製品設計
上市を見据えて、治験や薬事申請に適した製品設計を提案します。
原料等の設定
「生物由来原料基準」等に基づいた原料等の設定に対応します。
製造方法確立
製造工程での「カギ」となる部分を見つけ出し、作業者が安定的に製造できるよう、製品の作りこみを行います。
製品規格設定
その製品に合った「安全性」と「有効性」の規格及び品質試験方法を提案します。
治験計画立案
上市を見据えて、対象疾患に沿った治験計画(評価項目、症例数、解析方法等)を提案します。
包装・輸送方法設定
最終製品の特性や形状により、包装や輸送方法、保存期間等が変わってきます。その製品に適した方法を提案します。
- 治験(CDMO)
-
治験製品製造
製品開発ステージで確定した各手順書に則り、治験製品の製造・品質試験・包装等を行います。
- 治験(CRO)
-
登録センター業務
患者様が治験の条件を満たしているか確認し、対象疾患の患者様を治験に組み入れる業務を行います。
モニタリング・監査
定められたルール(「Good Clinical Practice:GCP」といいます)や治験実施計画書に従って治験が適切に行われているか確認します。
データマネジメント
治験で収集されたデータを正確に管理し、解析可能な状態に整えます。
統計解析
治験製品の有効性や安全性を評価するため、治験で収集されたデータを統計学的に解析します。
メディカルライティング
治験の実施計画書や総括報告書など、治験に関する文書の作成を行います。
- 承認
-
申請書作成
製造方法、規格、試験方法、効能・効果、治験の試験成績などを記載した製造販売承認申請書を作成します。
照会対応
製造販売承認申請書を提出後、PMDAから申請内容に関する問い合わせ(照会事項)が入ります。照会事項に対する回答案を提案します。
- 市販
-
製品製造
承認された製造方法に従って、製品製造を行います。
品質検査
承認された品質検査項目と検査方法に従って、品質検査を行います。
使用成績調査
承認された製品の特性に応じて期間を設定し、当該期間中に使用成績(安全性や有効性)を確認するための調査を行います。
「再生医療等安全性確保法」に基づくサービス内容
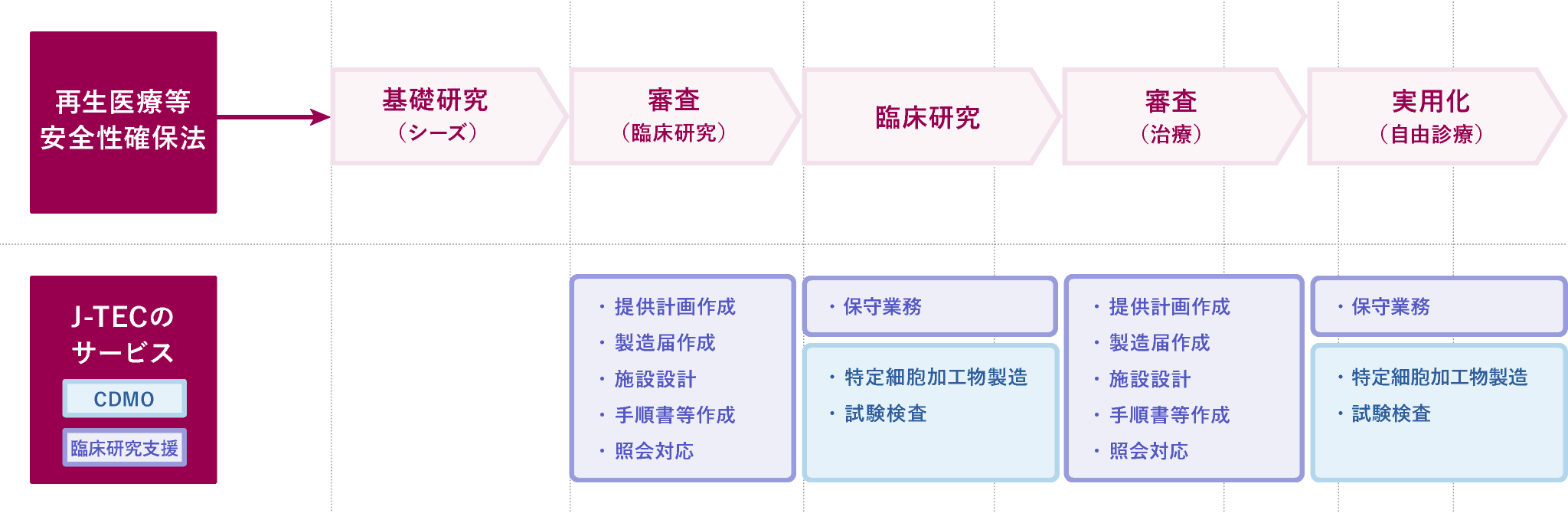
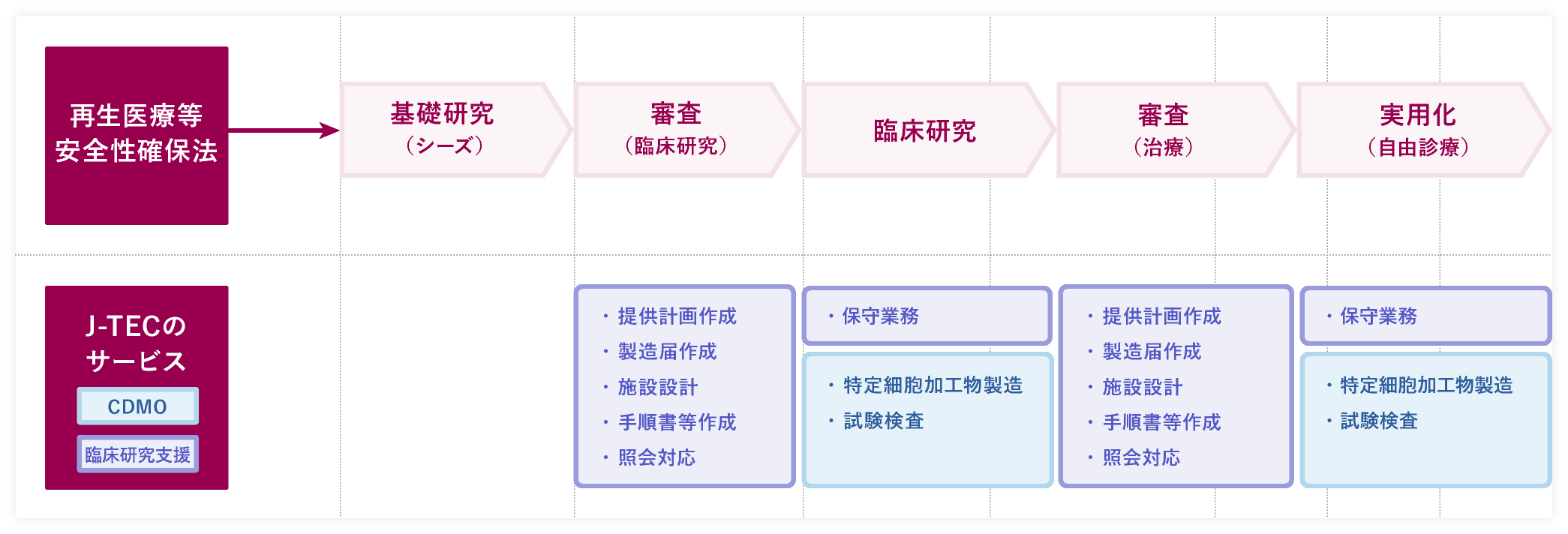
お問い合わせ
ご質問や、個別のご相談につきましては、下記のお問い合わせフォームよりご連絡ください。担当より追ってご案内いたします。

