株式会社ジャパン・ティッシュエンジニアリング(J-TEC)は、2007年に日本で最初の再生医療等製品の製造販売承認を受けてから、有効性・安全性を保証した高品質な製品を安定供給してきました。
「再生医療をあたりまえの医療に」を合言葉に、再生医療が特別ではなく身近な医療となるように、安全性を担保した製品製造と、信頼性を保証する活動を行っています。
高品質な製品の安定供給を実現する生産体制の構築
自家の再生医療等製品は、患者さまお一人お一人の組織から作られるオーダーメイドの製品です。作り直しができないため、高品質な製品を安定して製造することが要求されます。また、外用医薬品や化粧品等の研究開発支援を目的とした製品も提供しております。いずれの製品も十分な教育訓練を受けた作業者が定められた手順に従い、安定した製造や検査作業を行っています。

J-TEC本社工場(右)と研究棟(左)
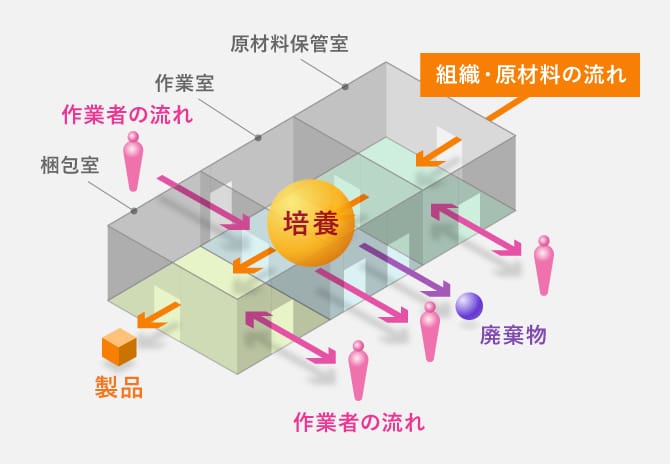
施設レイアウトイメージ
製品の安定供給を可能にする取組み
製造

教育訓練により細胞培養に関する専門的な知識・技能を身につけた作業者が製造作業に従事しています。再生医療学会が認定する臨床培養士資格の取得推進や、社内独自のマイスター制度を整備しており、知識・技能の向上・維持に努めています。
品質管理

原材料の受け入れから製品の出荷までの工程で、最新の知見に基づいた品質試験を実施しています。日本規格協会が認定するQC検定の取得推進や、社内独自のマイスター制度を整備しており、知識・技能の向上・維持に努めています。
生産管理

患者さまご自身の細胞を扱う製品の特性を把握したうえで出荷スケジュールの調整を行うことで、確実な製品出荷に努めています。
購買管理

原材料や資材の調達・受入・保管においては、供給者からの情報収集や社内コード管理によるトレサビリティの確保を行うことで、徹底した管理体制を構築しています。
生産技術
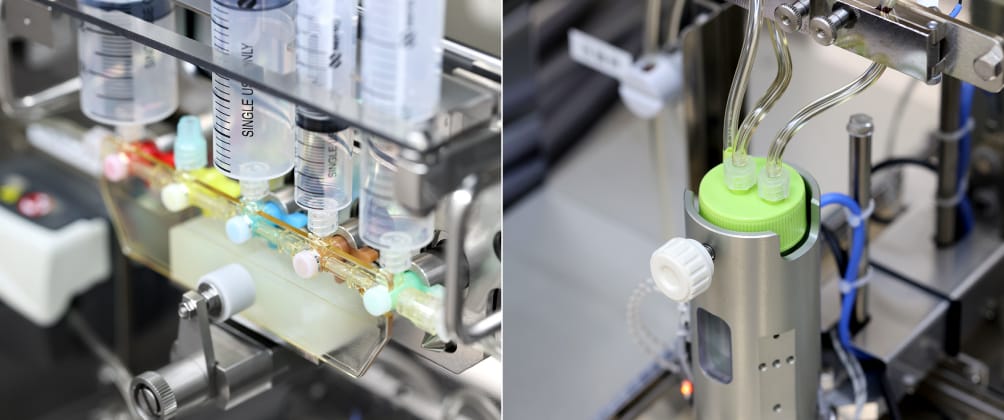
複数品目の自家培養製品の生産を効率的で安定的に実現するため、技術的な支援を行っています。例えば、高度なスキルを身につけた作業者が長時間従事しなければならない負荷の高い工程を対象として、コンパクトな自動・機械化装置や作業支援ツールを開発しています。
安心・安全を確保するクリーン環境の維持
患者さまの組織・細胞をクリーンに取り扱うために、特殊なフィルター※1によりハイレベルな無菌操作環境※2を維持できる安全キャビネットをクリーンルーム※3内に導入しています。
- HEPA(High Efficiency Particulate Air)フィルターを使用。粒径0.3μmの微粒子を99.97%以上の集塵効率でキャッチし、空気を浄化するフィルター。クリーンルームや無菌操作環境を構築する際に使用される。
- クリーン度は、クラス100。HEPAフィルターを使用し、0.5ミクロン(0.0005mm)以上の浮遊物質の数を、1立方フィート(一辺30.5cmの立方体)あたり100個以下に保ったクリーン環境をいう。
- クリーン度は、クラス10,000。*2と同様の浮遊物質の数を、1立方フィートあたり10,000個以下に保ったクリーン環境をいう。

安全キャビネットでの無菌操作

クリーンルーム通路
製品の品質向上に向けた厳重な設備監視及びモニタリング
クリーン環境を維持するための空調設備や細胞培養設備等の運転状況を24時間モニタリングし、全ての運転記録を保存します。万一、設備に異常が発生した際にはアラームを発報し、管理者へ連絡する体制を構築しています。また、製造施設へはセキュリティシステムにより⼊室を制限し、かつウェブカメラにて⼊室者及び作業状況を確認できる設備を導⼊しており、製品の品質向上に役立てています。

設備のモニタリング

空調設備のチェック
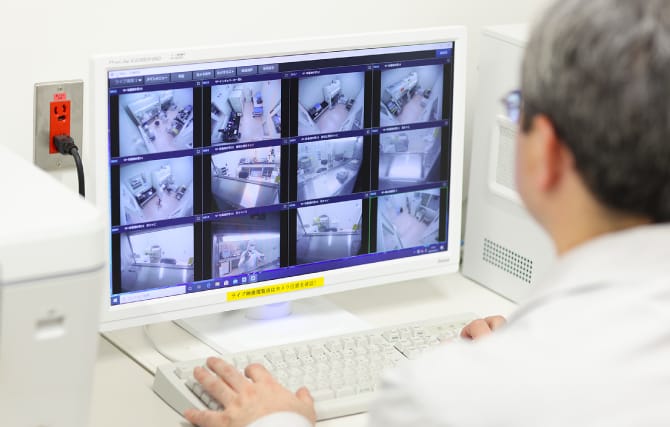
ウェブカメラによる入室者及び作業状況の確認
安心・安全を保証する信頼性保証体制の構築
私たちは、お客さまの満足を得られるよう、安心・安全で品質の高い再生医療製品および再生医療関連サービスを提供しなければなりません。J-TECはこれらの要求事項を満たすため、「品質方針」を定め、再生医療業界のリーディングカンパニーとして責任ある事業を展開すべく、信頼性保証体制を構築しています。
品質方針
ジャパン・ティッシュエンジニアリングは、再生医療のリーディングカンパニーとして「法令・倫理遵守の下、患者様のQOL向上に貢献する」という企業理念を掲げ、品質の高い再生医療等製品、医療機器および再生医療関連サービスを提供するために、本方針に基づき事業を展開する。
- 1社会から求められる企業として、患者様・医療従事者の皆様の満足と信頼の獲得を目指す。
- 2再生医療の技術革新に努め、グローバルに通用する最高水準の品質を追求する。
- 3法令およびルールを遵守し、かつ高度な倫理観をもつ。
- 4患者様・医療従事者の皆様に正確な情報を適切に提供する。
- 5医療現場の声を大切にし、常に品質の改善に取り組む。
J-TECでは、厚生労働省の定める省令・通知に従い、研究開発・治験、製造・検査、販売・製造販売後対応を行っています。そして、それらの部門から独立した信頼性保証部門が、研究開発で実施する試験の信頼性保証、治験の監査、製造販売後の品質保証・安全管理・製造販売後調査に関する業務を一元的に管理し、信頼性保証活動をおこなっています。
品質マネジメントシステム
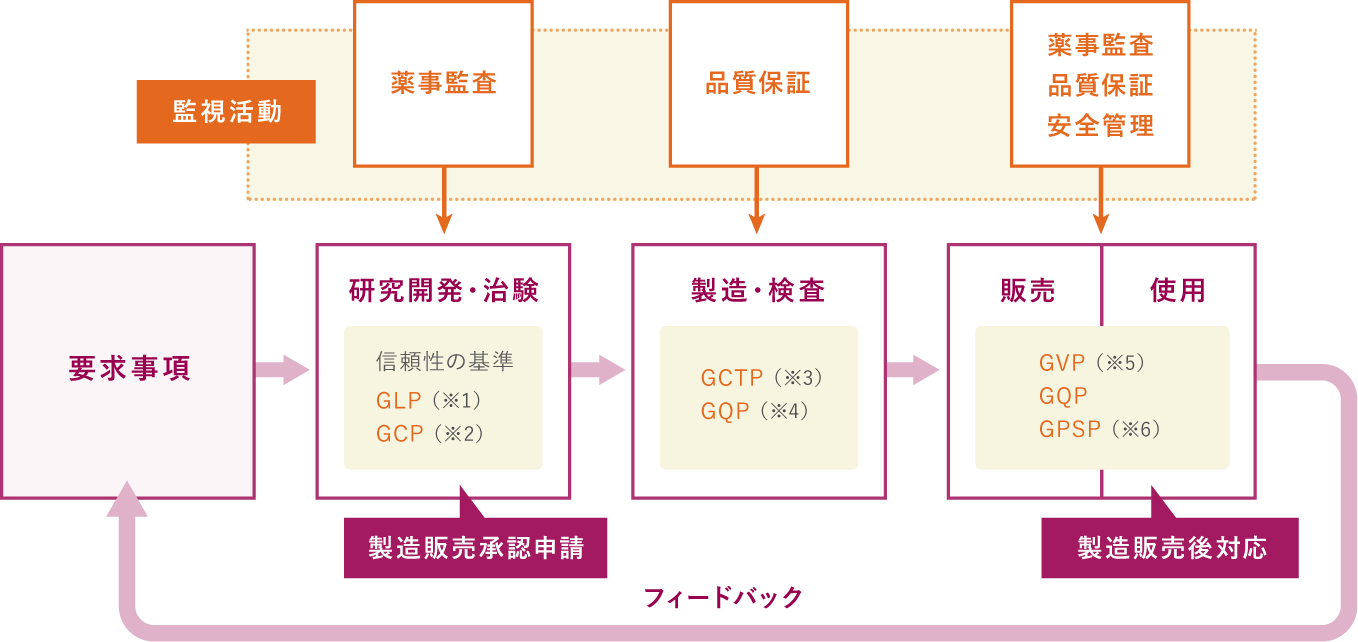
- GLP:再生医療等製品の安全性に関する非臨床試験の実施の基準に関する省令
- GCP:再生医療等製品の臨床試験の実施の基準に関する省令
- GCTP:再生医療等製品の製造管理及び品質管理の基準に関する省令
- GQP:医薬品、医薬部外品、化粧品及び再生医療等製品の品質管理の基準に関する省令
- GVP:医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令
- GPSP:再生医療等製品の製造販売後の調査及び試験の実施の基準に関する省令
信頼性保証活動
薬事監査活動
再生医療等製品の製造・販売には厚生労働省の承認が必要です。製造販売承認申請には膨大な資料が当局に提出され、審査が行われます。その資料の基となる試験データの取り扱いは極めて重要です。また、製造販売後の調査及び試験も信頼性が確保されていなければなりません。
J-TECでは、薬事監査部門が非臨床試験・治験の調査・監査を行い、製品の有効性・安全性に関わる試験の信頼性を保証しています。また、製造販売後の品質保証活動・安全管理活動・調査活動が適切に実施されているかを監査し、その信頼性を保証しています。

品質保証活動
製品の品質を維持するために、定めた手順に従って製造・検査を行う必要があります。また、医療機関等からの製品の品質に関わる情報を収集・分析し、必要に応じ適切な措置を取る必要があります。
J-TECでは、品質保証部門が、適切に製造管理・品質管理活動が行われていることを監視し、製品の品質が維持されていることを確認するとともに、医療機関等から収集した品質情報を関連部門と連携して分析・検討し、必要な改善を実施することにより、製品の品質の確保に努めています。

安全管理活動
再生医療等製品の安全性を確保するためには、医療機関等からの製品の安全性に関わる情報を収集・分析し、必要に応じ適切な安全確保措置を取る必要があります。
J-TECでは、安全管理部門が医療機関等から収集した情報を分析・検討し、必要に応じ規制当局への報告、医療機関への情報提供等の必要な措置を迅速かつ確実に行い、患者さまの安全確保に努めています。

製造販売後調査活動
再生医療等製品は、原則として承認後の一定期間、医療機関において製品が使用された患者さまのデータを収集し、承認された効能効果、安全性について、再度確認する調査活動が求められています。
J-TECでは、安全管理部門が医療機関から収集した患者さまのデータを分析し、毎年その効能効果、安全性について確認し、規制当局に報告します。さらに、一定期間終了後には確認した結果を取りまとめ、再審査申請を行います。

