製品概要
| 承認年月日 | 2012年7月27日 |
|---|---|
| 一般的名称 | ヒト(自己)軟骨由来組織 |
| 販売名 | ジャック |

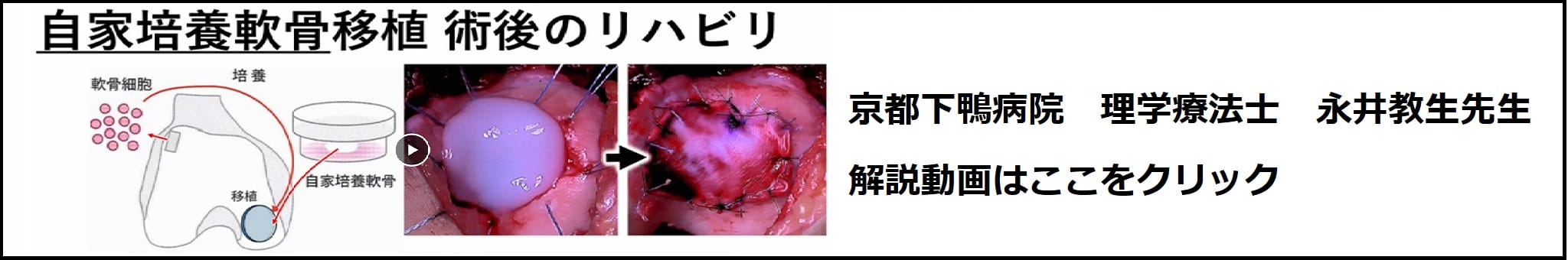
自家培養軟骨ジャック®は、越智教授(広島大学 整形外科)らの方法に準じて製造された自家培養軟骨であり、株式会社ジャパン・ティッシュエンジニアリングの技術によって生産管理された製品です。越智教授らの報告で用いられているアテロコラーゲンと同一のコラーゲンを用い、患者さまご自身の軟骨細胞を包埋し培養しています。
ジャック®の製造工程では、組織の受け入れ検査、工程検査、出荷検査、確認検査など、製品としての安全性・有効性を担保する規格を設定し、厳密な品質管理を行っています。
ジャック®は、患者さまからおあずかりした細胞を培養してつくられているため、お引き受けしてから製造を開始する完全なテーラーメイドの製品です。治療にあたっては、患者さま、治療にあたる先生方と、当社との間で十分な連携が不可欠です。
自家培養軟骨ジャック®の添付文書は独立行政法人医薬品医療機器総合機構のホームページ(再生医療等製品添付文書)にてご覧いただけます。